Este gráfico de barras muestra la estructura de la proteína con púas de la variante delta antes de que el virus se fusionara con la célula diana. El dominio N-terminal (NTD) se muestra en azul y el dominio de unión al receptor (RBD) se muestra en cian. Crédito: Bing Chen, Ph.D., Boston Children’s Hospital
Los resultados tienen implicaciones para la próxima generación COVID-19 Vacunas y tratamientos.
delta alternativo de SARS-CoV-2 Barrió el mundo, convirtiéndose en la alternativa dominante en solo unos meses. Un nuevo estudio del Boston Children’s Hospital, publicado el 26 de octubre de 2021 en Ciencias, explica por qué Delta se propaga con tanta facilidad e infecta a las personas con tanta rapidez, y sugiere una estrategia más específica para desarrollar futuras vacunas y tratamientos contra COVID-19.
La primavera pasada, el líder del estudio Bing Chen, PhD, mostró cómo varias variantes anteriores del SARS-CoV-2 (alfa, beta, G614) se volvieron más infecciosas que el virus original. Cada variante adquirió un cambio genético que estabilizó la proteína de pico, la proteína de superficie de la que dependen las vacunas actuales. Esta mutación aumentó la capacidad de la variante para ingresar a las células.
La variante delta, que apareció poco después, es el tipo más infeccioso conocido hasta la fecha. Chen y su colega procedieron a comprender por qué. «Pensamos que tenía que suceder algo completamente diferente, porque delta se destaca entre todas las variables», dice Chen. «Encontramos una propiedad que creemos que es responsable de su portabilidad y hasta ahora parece ser exclusiva de Delta».
Integración rápida, entrada rápida
Para que el SARS-CoV-2 infecte nuestras células, sus mutaciones primero se unen a un receptor llamado ACE2. Luego, las uñas cambian drásticamente su forma, se pliegan sobre sí mismas. El movimiento del elevador fusiona la membrana externa del virus con las membranas de nuestras células.
Usando dos tipos de ensayos basados en células, Chen y sus colegas muestran que la proteína spike delta es particularmente experta en la fusión de membranas. Esto permitió que el virus de imitación delta infectara células humanas mucho más rápida y eficientemente que las otras cinco variantes de SARS-CoV-2 (ver gráfico de barras). Esto fue particularmente cierto cuando las células contenían cantidades relativamente bajas de receptores ACE2.
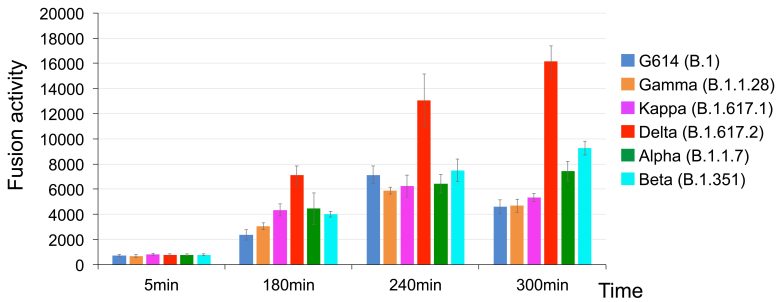
La variante delta de SARS-CoV-2 se incorporó a las membranas celulares mucho más rápidamente que otras cinco variantes (Alpha, Beta, G614, Gamma y Kappa). crédito: Zhang J; et al. Science 2021 26 de octubre; DOI: 10.1126 / science.abl9463
«La fusión de membranas requiere mucha energía y necesita un catalizador», explica Chen. Entre las diversas variantes, delta se destacó por su capacidad para inducir la fusión de membranas. Esto explica por qué el delta viaja más rápido, por qué puede contraerlo después de un tiempo de exposición más corto y por qué puede infectar más células y producir cargas virales tan altas en el cuerpo.
Diseño de intervenciones, en base a la estructura
Para descubrir cómo las mutaciones en variantes afectan la estructura de la proteína puntiaguda, Chen y sus colegas utilizaron microscopía electrónica criogénica, que tiene resolución a nivel atómico. Obtuvieron imágenes de proteínas de pico de las variantes Delta, Kappa y Gamma, y las compararon con picos de las variantes G614, Alfa y Beta caracterizadas previamente.
Todas las variantes contienen cambios en dos partes principales de la proteína puntiaguda que fueron reconocidas por nuestros anticuerpos neutralizantes del sistema inmunológico: el dominio de unión al receptor (RBD), que se une al receptor ACE2, y el dominio N-terminal (NTD). Las mutaciones en cualquiera de los dominios pueden hacer que los anticuerpos neutralizantes sean menos capaces de unirse a la mutación.
«Lo primero que notamos sobre Delta fue que hubo un cambio significativo en el NTD, que es responsable de su resistencia a los anticuerpos neutralizantes», dice Chen. El RBD también cambió, pero esto dio como resultado un pequeño cambio en la resistencia a los anticuerpos. Delta siguió siendo sensible a todos los anticuerpos dirigidos a RBD que probamos «.
Al observar las otras variantes, los investigadores encontraron que cada una modulaba la NTD de diferentes maneras que alteraban sus parámetros. El RBD también sufrió una mutación, pero los cambios fueron más limitados. En general, la estructura de RBD se ha mantenido relativamente estable en todas las variantes y es probable que mantenga su papel crítico en la unión a los receptores ACE2. Por tanto, los investigadores creen que la RBD es un objetivo más adecuado para la próxima generación de vacunas y terapias con anticuerpos.
«No queremos apuntar a las ETD, porque el virus puede mutar rápidamente y cambiar su estructura; es un objetivo en movimiento», explica Chen. «Dirigirse al RBD puede ser más efectivo: enfocar el sistema inmunológico en esta área crítica en lugar de en toda la proteína de pico».
Referencia: “Fusión de membranas y evasión inmune por proteína de pico de la variante delta del SARS-CoV-2” por Jun Zhang, Tianshu Xiao, Yongfei Cai, Christy L.Lavine, Hanqin Peng, Haisun Zhu, Krishna Anand, Pei Tong, Avneesh Gautam , Megan L.Mayer, Richard M. Walsh, Jr., Sophia Ritz-Fuloch, Duan R. Weissman, Wei Yang, Michael S. Seaman, Jianming Lu y Peng Chen, 26 de octubre de 2021. Ciencias.
DOI: 10.1126 / science.abl9463
Jun Zhang, PhD, y Tianshu Xiao, PhD del Boston Children’s Hospital, fueron los primeros coautores del artículo. El estudio fue financiado por Emergent Ventures, Massachusetts Consortium on Pathogen Readiness (MassCPR) y los Institutos Nacionales de Salud (subvenciones AI147884, AI141002, AI127193, AI39538 y AI165072).

«Jugador. Wannabe evangelista de la cerveza. Practicante de la cultura pop. Amante de los viajes. Defensor de las redes sociales».




More Stories
Un dentista encuentra una antigua mandíbula humana incrustada en el suelo de la casa de sus padres
Lucha para protegerte de la gripe aviar con láseres y bailarinas hinchables
Estudiantes de la UCF excavan el primer sitio de lanzamiento en el Cabo antes del 75 aniversario