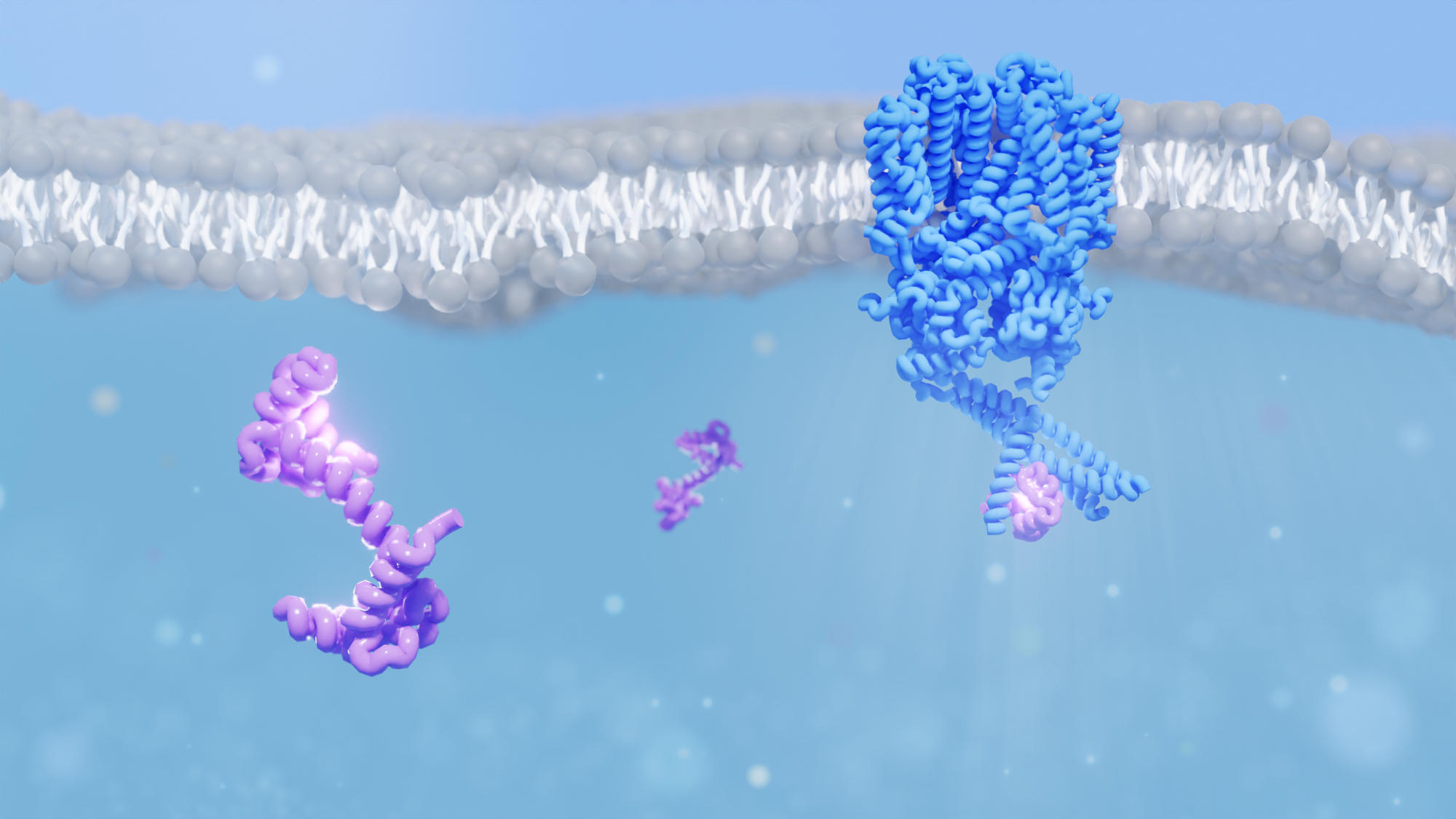
Los investigadores decodificaron la estructura del canal iónico de las células de bastón del ojo (que se muestran en azul) cuando interactuaban con la proteína calodulina (púrpura). Esta interacción es importante no solo para la función de los canales iónicos en el ojo, sino también para la función de los canales iónicos en otras partes del cuerpo, como el corazón. Crédito: Instituto Paul Scherrer/Dina Schuster
Nuevos hallazgos emocionantes arrojan luz sobre la interacción entre la proteína calodulina y un canal de iones en el ojo, lo que puede revelar el secreto detrás de la excepcional sensibilidad de nuestros ojos a las condiciones de poca luz.
Usando microscopía electrónica criogénica y espectrometría de masas, un equipo de investigadores de PSI logró revelar la estructura del canal iónico en el ojo donde interactúa con la proteína calodulina, un misterio que ha desconcertado a los científicos durante 30 años. Esta reacción podría explicar cómo nuestros ojos pueden lograr una sensibilidad tan notable a la luz tenue. Los resultados han sido publicados en la revista PNAS.
Cuando miras la pantalla brillante de tu teléfono o computadora, los canales de iones en tus ojos reaccionan a la luz cerrándolos. Esta acción representa la culminación de una reacción química en cadena iniciada por la exposición a la luz. Como resultado, los iones de calcio ya no pueden atravesar los canales de la membrana celular, lo que conduce a la conversión de la señal bioquímica en una señal eléctrica. Esta señal luego viaja a través de su sistema nervioso y finalmente llega a su cerebro para su procesamiento.
El mismo proceso ocurre cuando estás parado afuera por la noche y mirando hacia el cielo. Ahora, las células de varilla hacen el truco. Estas son las células que hacen que nuestros ojos sean sensibles a los niveles bajos de luz, lo que nos permite mirar hacia el cielo nocturno y detectar algunos fotones de luz de una estrella distante. Damos esto por sentado, pero es una hazaña increíble.
Ahora, un equipo dirigido por el científico de PSI, Jacopo Marino, ha mejorado nuestra comprensión de cómo una pequeña proteína llamada calmodulina ayuda a hacer esto, al interactuar con los canales iónicos en las células de varilla. La calmodulina es un sensor de calcio. Permite que la célula responda a las fluctuaciones del calcio, uno de los métodos de comunicación universales de la célula. El equipo, una colaboración entre grupos de PSI, ETH Zurich y la Universidad de Bonn, ha aclarado la estructura tridimensional de un canal iónico de nucleótido cíclico (CNG) que se une a la calmodulina.
Una función importante de la calmodulina en el ojo
Hace un año, los investigadores lograron descifrar la estructura de este mismo canal iónico, que se encuentra en los bastoncillos de la retina de la vaca e idéntico al canal iónico que se encuentra en los bastoncillos de nuestros ojos. El GNC de varilla consta de cuatro subunidades, una estructura común a muchos otros canales iónicos. Sin embargo, la peculiaridad del canal es que tres subunidades, conocidas como subunidad A, son idénticas, mientras que la cuarta, subunidad B, es diferente.
Los científicos saben desde hace tiempo que esta subunidad se une a la calmodulina. En todo el reino animal, se encuentra esta característica. Sin embargo, la naturaleza exacta de su papel seguía sin estar clara. «Si algo se ha preservado a través de la evolución, es una indicación muy fuerte de que es importante de alguna manera», explica Marino. «Sabíamos que la calmodulina modula la actividad del canal a través de la subunidad B, pero el tipo de cambios estructurales que se producen ha sido un gran misterio durante unos treinta años, principalmente porque la gente no ha podido resolver la estructura del canal iónico».
Ahora, los investigadores pueden proporcionar una vista en 3D de lo que realmente está sucediendo. A través de una combinación de microscopía crioelectrónica y espectrometría de masas, pudieron notar que cuando la calmodulina se une, el canal de iones se vuelve un poco más estrecho.
Los investigadores creen que esta es la forma en que la naturaleza cierra los canales. ¿Cuál sería el propósito de esto? “Creemos que es una forma de reducir las aperturas de conductos espontáneos que pueden causar ruido de fondo para que nuestros ojos sean sensibles a la poca luz”, dice Marino.
La espectrometría de masas ayuda a los investigadores a resolver la estructura en zigzag
Obtener la estructura de la calmodulina y ligar el canal iónico no fue fácil. La interacción entre la calmodulina y el Rod CNG tiene lugar en una región altamente elástica del conducto, donde puede oscilar libremente. En microscopía crioelectrónica, esto hace que sea muy difícil obtener información estructural de alta resolución. Aquí, Marino ofrece una analogía: «Imagina que tienes una habitación con gente bailando. Tomas una foto y quieres deducir de ella la forma de un cuerpo humano. Es posible que puedas decir cómo es una cabeza, pero con las extremidades». ondeando por todas partes, las piernas y los brazos se verán borrosos”.
Gracias a un encuentro casual, el equipo pudo identificar esta estructura irregular. Doctor. La estudiante Dina Schuster escuchó una presentación de Marino. «Nos estábamos preparando para publicar basándonos solo en datos de microscopía crioelectrónica, lo que dejó gran parte de la reacción ambigua, cuando Dina se me acercó y me dijo ‘Creo que puedo ayudarte'», recuerda.
Schuster está desarrollando nuevas estrategias basadas en espectrometría de masas para estudiar las interacciones entre proteínas. Estas técnicas usan enzimas para cortar proteínas en pedazos, ya sea en condiciones nativas dentro de partes de la membrana retiniana o mediante reticulación química. Los fragmentos de proteína, que están unidos entre sí, se identifican mediante espectrometría de masas. Esto reveló información sobre qué partes de la proteína estaban juntas en un espacio tridimensional, el equivalente a armar un rompecabezas tridimensional. «Estas técnicas nos han permitido reducir algunas posibilidades que de otro modo serían oscuras con la microscopía crioelectrónica», explica Schuster, quien es el primer autor de la publicación junto con la estudiante de doctorado, Diane Barrett.
Del milagro de la visión a las implicaciones para la salud humana
La calmodulina regula los canales iónicos no solo en los ojos sino en todo el cuerpo, controlando las señales eléctricas que son esenciales para el correcto funcionamiento de varios músculos y órganos. En los últimos años, ha quedado claro que cuando esta reacción falla debido a mutaciones en el gen de la calodulina, puede haber efectos graves en la salud, como insuficiencia cardíaca: algo que aún no se comprende del todo.
Además de ayudarnos a comprender una de las maravillas fundamentales: cómo podemos ver las estrellas, los resultados de este estudio y los métodos utilizados pueden ayudarnos a comprender la interacción de la calmodulina con los canales iónicos en otras partes del cuerpo.
Referencia: «Bases estructurales de la modificación de Codolin del canal de nucleótidos cíclicos de varillas» Por Diane C.A. Barrett, Dina Schuster, Matthew J. Rodrigues, Alexander Leitner, Paola Picotti, Gibbard FX Schertler, U. Benjamin Cobb, Volodymyr M. Korkov y Jacobo Marino, 3 de abril de 2023, disponible aquí. procedimientos de la Academia Nacional de Ciencias.
DOI: 10.1073/pnas.2300309120

«Jugador. Wannabe evangelista de la cerveza. Practicante de la cultura pop. Amante de los viajes. Defensor de las redes sociales».





More Stories
Hubble celebra su 34 aniversario con una mirada a la Nebulosa Pequeña Mancuerna
Los científicos dicen que el USDA está compartiendo muy pocos datos y con demasiada lentitud sobre la influenza H5N1
Un dentista encuentra una antigua mandíbula humana incrustada en el suelo de la casa de sus padres